Le Lithium est le plus léger des métaux, il offre un plus grand potentiel électrochimique, et il génère une plus grande quantité d’énergie.
La particularité de l’anode des accumulateurs rechargeables au Lithium est qu’elle n’est pas métallique, mais en ions de Lithium . La cathode est en oxyde de Cobalt ou de Manganèse.
- L’anode.
A l’origine les batteries au Lithium avaient une électrode négative en coke. Depuis 1997 la plupart des Li-ion ont une anode en Graphite qui permet d’obtenir une courbe de décharge beaucoup plus plate. Ceci a aussi l’avantage d’avoir une tension de fin de décharge de 3 Volts au lieu de 2,5 Volts avec le coke.
- La Cathode.
Pour la Cathode on distingue aujourd’hui majoritairement deux compositions chimiques qui sont le Cobalt et le Manganèse également connu sous le nom de spinelle. Le spinelle est par nature plus sécuritaire et moins dangereux.
On trouve donc aujourd’hui essentiellement deux types d’accumulateurs au lithium.- – Les éléments à Cathode au Cobalt dénommés Lithium-ion (Li-ion
- – Les éléments à Cathode au Manganèse (Spinelle) dénommés Lithium-ion Polymères (Li-po)
Voici la réaction chimique mise en jeu dans les accus Li-ion (à cathode Cobalt).

Voici la réaction pour les accus Li-po
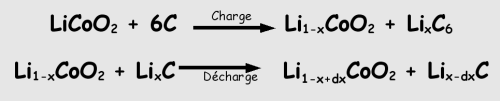
Attention : Je ne suis pas complètement sûr de la formule elle même car je la trouve proche de celle ci-dessus ni de l’annotation exacte des valeurs à mettre ou pas en indice, la source fournie ne les indique pas : http://www.clubmodelistes.com/batteries_lithium_polymere.aspx (Merci gege33 pour cette info)
